Estrutura
Os ensaios clínicos são o exemplo paradigmático dos estudos experimentais em investigação médica. Outros estudos experimentais são os ensaios de campo e os ensaios de intervenção na comunidade. Têm todos estruturas semelhantes, mas nos ensaios clínicos os indivíduos em estudo têm uma determinada doença, avaliando-se, portanto, tratamentos; nos ensaios de campo ainda não têm doença, avaliando-se, deste modo, intervenções terapêuticas; e nos ensaios de intervenção na comunidade acontece o mesmo que nos ensaios de campo, mas as intervenções são aplicadas com base na comunidade.
A principal vantagem destes estudos, em oposição aos observacionais, é permitirem evitar erros sistemáticos, devido ao facto de controlarem a intervenção e a aplicarem de um modo aleatório, tornando, assim, os grupos que são definidos comparáveis. Esses grupos dizem-se comparáveis porque devido ao processo de aleatorização da intervenção as características que podem variar entre os grupos e que podem estar relacionados com a intervenção, a doença ou o seu prognóstico estão distribuídas homogeneamente entre eles, ou, pelo menos, assim é esperado.

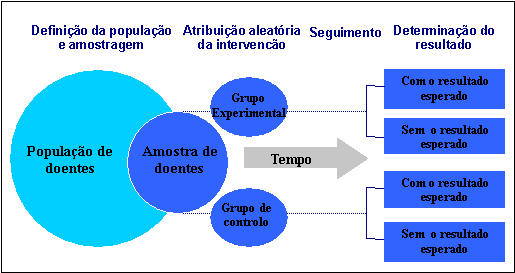
Figura
1. Desenho de
um ensaio clínico randomizado.
Em termos práticos (ver figura 7), ao levar a cabo um ensaio clínico o investigador começa por definir a população que se pretende estudar, que será constíuida por casos de uma determinada doença, e escolhe uma amostra aleatória dessa população. Na escolha da amostra é importante a definição de critérios de inclusão e/ou exclusão que tornem a amostra mais homogénea, aumentando, assim, a validade interna do estudo, à custa, no entanto, de uma diminuição da capacidade de generalização.
Aos indivíduos dessa amostra é, então, de um modo aleatório, aplicada a intervenção que se pretende estudar ou uma intervenção alternativa, com a qual a primeira será comparada (pode não ser de modo aleatório e, nesse caso, são ensaios clínicos não randomizados). São, assim, aleatoriamente definidos dois grupos: um que recebe a intervenção (o tratamento de que se pretende avaliar a eficácia) – grupo experimental; e um outro que recebe uma intervenção alternativa (um placebo, o tratamento convencional ou um outro tratamento alternativo) – grupo controlo. A atribuição aleatória da intervenção permite, em principio, garantir a comparabilidade dos dois grupos assim definidos, excepto, no que toca à intervenção a ser avaliada. É importante, para evitar erros sistemáticos, que ao doente seja, na medida do possível, ocultado o grupo, experimental ou de controlo, a que pertence, uma vez que este conhecimento poderá influenciar o seu comportamento em relação à intervenção que lhe foi atribuída.
Segue-se um período durante o qual as intervenções são aplicadas, os indivíduos são seguidos e a sua evolução clínica avaliada.
São, depois, verificados os resultados esperados no grupo experimental e no de controlo (ex: diferenças de mortalidade por doença cardiovascular em doentes tratados com um novo anti-hipertensor comparado com um anti-hipertensor de eficácia conhecida, neste caso, o resultado esperado definido foi a morte por doença cardiovascular). É importante, para evitar erros sistemáticos, que ao investigador que avalia os resultados esperados seja ocultado o grupo, experimental ou de controlo, a que o doente pertence. Quando num ensaio clínico é ocultado o grupo a que o indivíduo pertence ao próprio doente e ao investigador que avalia o resultado final, o ensaio diz-se ter duplo ocultamento.
Por último, analisam-se as diferenças existentes entre os dois grupos definidos, no que diz respeito ao resultado final, tendo em conta, preferencialmente, a randomização inicialmente feita (análise do tipo "intention to treat"). Isto permitirá o calculo de medidas de associação e impacto (vide supra as medidas de associação e impacto utilizadas nos estudos de coorte) que permitem definir o efeito da intervenção em estudo na doença em causa. Devido ao processo utilizado, qualquer diferença existente entre os grupos é atribuída à intervenção que está a ser avaliada. Num ensaio clínico temos que considerar, no entanto, a possibilidade de existirem outros efeitos para além do efeito específico devido à intervenção em estudo. Estes outros efeitos designam-se efeitos não específicos. Os efeitos não específicos podem ser de dois tipos: o efeito de Hawthorne, devido às alterações do comportamento dos participantes relacionadas, unicamente, com o facto de estarem a ser seguidos; e o efeito placebo, devido, unicamente, à aplicação de uma intervenção semelhante mas que não tem um mecanismo de acção específico conhecido (ex: ao dar comprimidos contendo o fármaco a avaliar ao grupo experimental e comprimidos contendo glicose ao grupo de controlo).
Vantagens
A grande vantagem dos estudos experimentais, nomeadamente os ensaios clínicos, é permitirem evitar, ou pelo menos controlar, erros sistemáticos através do processo de atribuição aleatória da intervenção, como foi já focado, e através do ocultamento a vários níveis (doente, investigador e responsável pela avaliação do resultado esperado), como foi, também, já focado.
Ligado ao acima exposto está o facto de, hoje em dia, se considerar o ensaio clínico randomizado e com duplo ocultamento como o método padrão de avaliação das intervenções terapêuticas. É este o método que confere a melhor evidência de eficácia de um determinado tratamento e é, hoje, obrigatório ter este tipo de estudos como base para justificar a utilização de qualquer tratamento.
Para além desta vantagem fundamental, estes estudos partilham todas as vantagens dos estudos de coorte, cuja estrutura é bastante semelhante à destes (vide supra vantagens dos estudos de coorte), uma vez que, como estes, são estudos prospectivos, longitudinais, analíticos, tem como unidade de análise o indivíduo e como base de classificação dos participantes a existência de uma determinada exposição, neste caso, a intervenção em estudo.
Desvantagens
As principais desvantagens destes estudos são: terem, geralmente, uma duração muito longa, existindo um grande período de tempo entre o início do estudo e o conhecimento dos resultados do estudo; serem estudos muito caros devido ao longo período de seguimento e à apertada avaliação que é feita a todos os indivíduos; serem pouco eficazes no estudo de doenças raras, uma vez que, nestes casos, se tornam mais longos e caros; e existirem questões éticas que impedem, muitas vezes, que estudos experimentais possam ser feitos em humanos.
Para além das já apontadas, existem outras desvantagens ligadas a aspectos operacionais do próprio estudo e que poderão ser responsáveis pela existência de erros sistemáticos, nomeadamente, a existência de indivíduos que não aderem às intervenções que lhe foram atribuídas, a existência de "drop-out" (indivíduos que abandonam o estudo), a existência de "cross-over" (indivíduos que deixam a intervenção que lhes foi atribuída e passam a ser tratados com a outra intervenção em estudo), ou o abandono da intervenção por um outro tratamento que não os incluídos no estudo. É, também, um importante problema a impossibilidade de, em certos casos, haver ocultamento, quer em relação aos doentes quer em relação aos investigadores.
Por último, deve referir-se que os ensaios clínicos são estudos que apresentam medidas da eficácia do tratamento no conjunto dos doentes analisados e, assim, eles não são uma garantia segura de eficácia em todos os doentes individualmente. Nos ensaios clínicos existe, por vezes, uma tão extensa selecção dos indivíduos a entrar no estudo, de modo a assegurar uma maior validade interna do mesmo, que a generalização a outros doentes pode ficar comprometida. Apesar de os ensaios clínicos serem a melhor razão para acreditar na eficácia de um tratamento, não há nada que ultrapasse a experiência do próprio doente com o tratamento.